 欢迎来到北京博奥森生物技术有限公司网站!
欢迎来到北京博奥森生物技术有限公司网站! 欢迎来到北京博奥森生物技术有限公司网站!
欢迎来到北京博奥森生物技术有限公司网站!
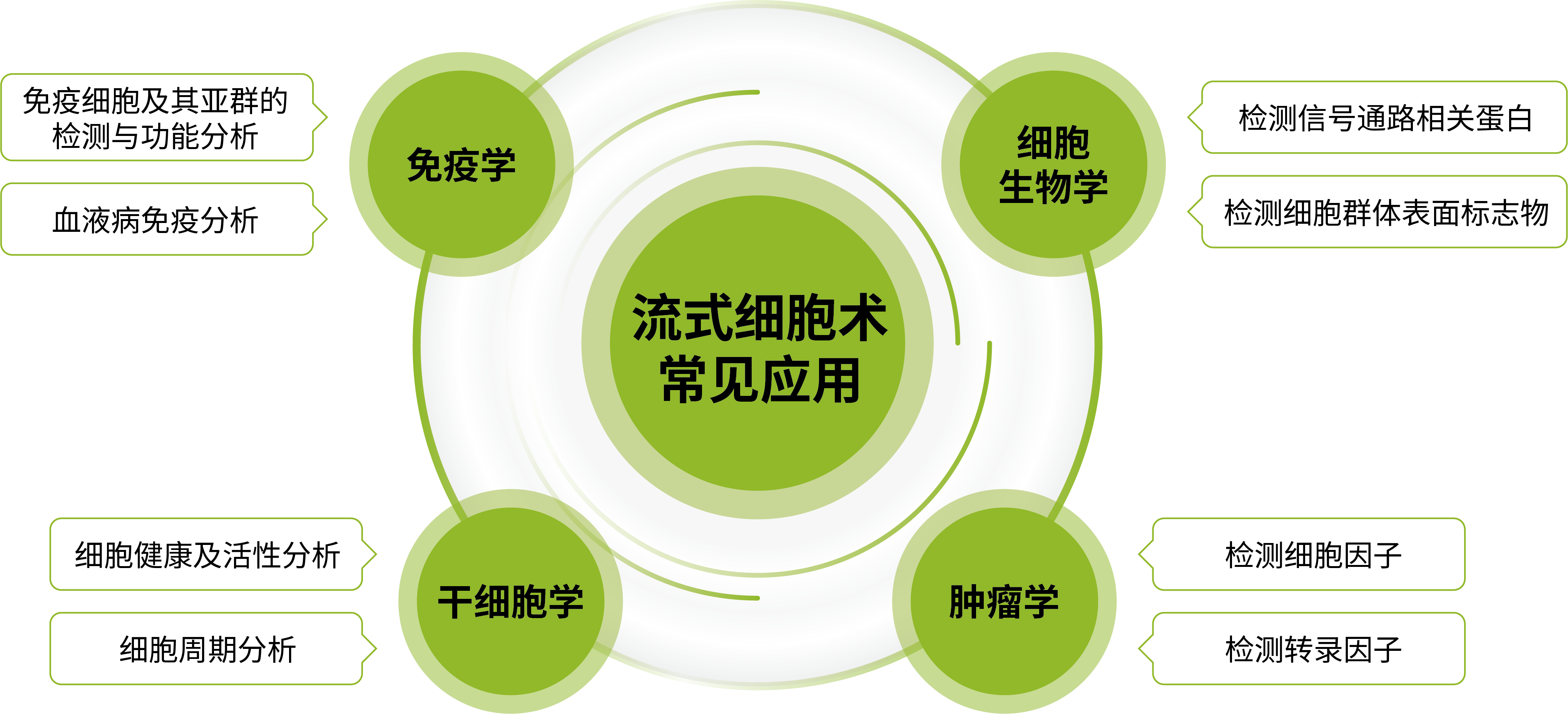
流式细胞术定义
流式细胞术(Flow Cytometry, FCM)是一种在功能水平上对液流中排成单列的动物、植物等细胞或其它生物微粒(如微球、细菌、病毒等)逐个进行多参数定量分析和分选的检测手段。该技术可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,具有速度快、精度高、准确性好、方法灵活等优点。流式细胞术不仅能够测量细胞的大小、内部颗粒的性状,还能检测细胞表面和胞浆抗原、细胞内DNA及RNA的含量。此外,流式细胞术能够从单细胞水平同时分析细胞样本中的基因表达和蛋白表达,还可以检测细胞活性、细胞周期、细胞凋亡、细胞增殖和细胞氧化等细胞功能。该技术不仅能获得在单个细胞水平上具有统计学意义的海量数据,还可以更加深入地了解异质性细胞群的详细信息。随着流式细胞术水平的不断提升,其应用范围也日益广泛,目前已普遍应用于免疫学、干细胞学、血液学、肿瘤学、药物学、生物化学、分子生物学、细胞生物学、细胞遗传学等基础医学和临床医学研究领域。
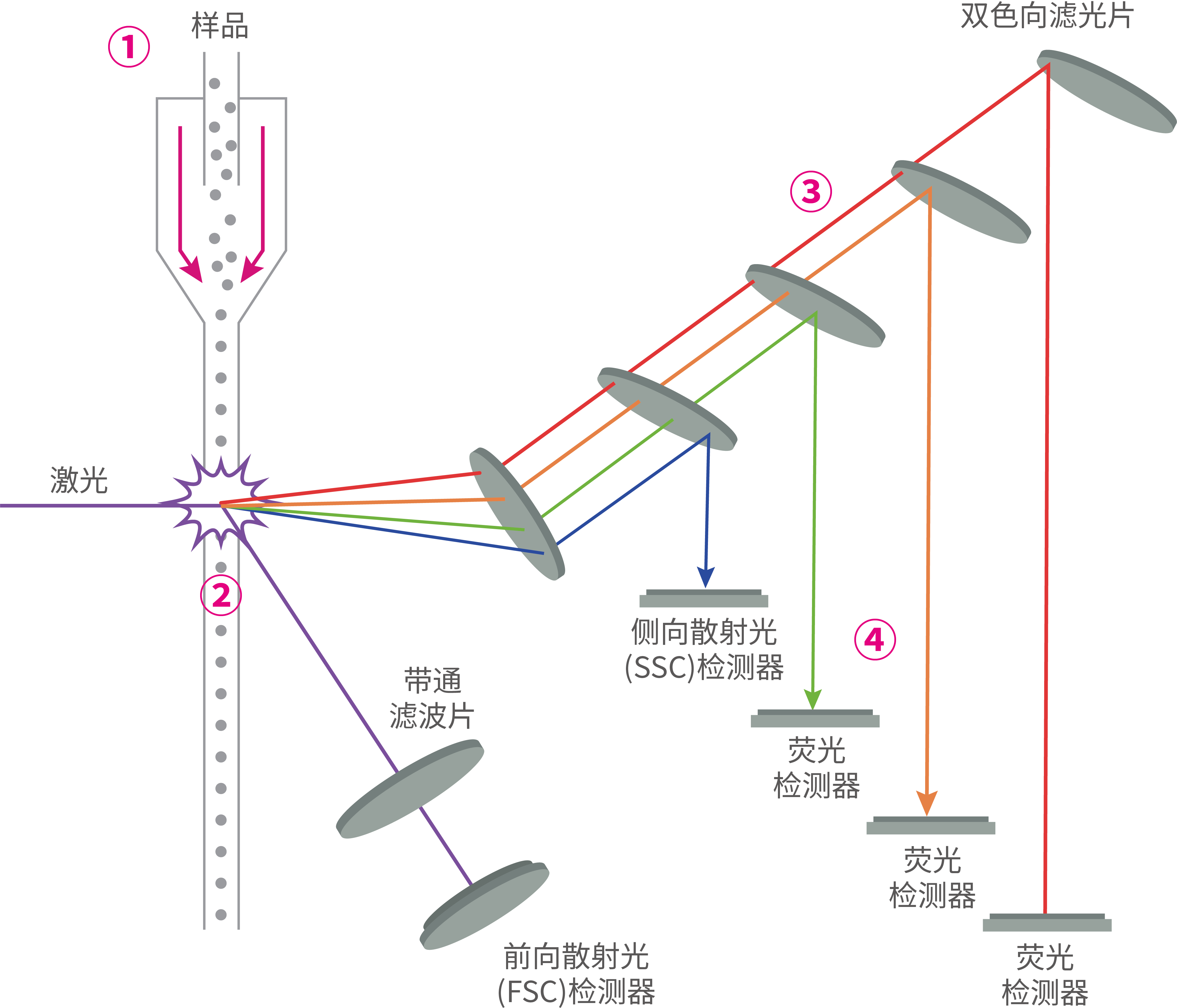
流式细胞仪的液流系统由流动室、样品管、鞘液管和喷嘴组成。样品在进入流动室之前,其中的细胞或微粒都是以随机的方式进行移动。在进入流动室之后,样品在液流压力的作用下从样品管中喷出,同时鞘液在高压下由鞘液管喷出,包裹在样品流四周,形成稳定的同轴流动状态,并使其聚焦为窄流,从而将细胞分离成单细胞列,然后从喷嘴高速喷出,形成细胞液柱。样品流中的细胞或微粒在鞘液的作用下,会以相同的速度逐一通过激光检测点。
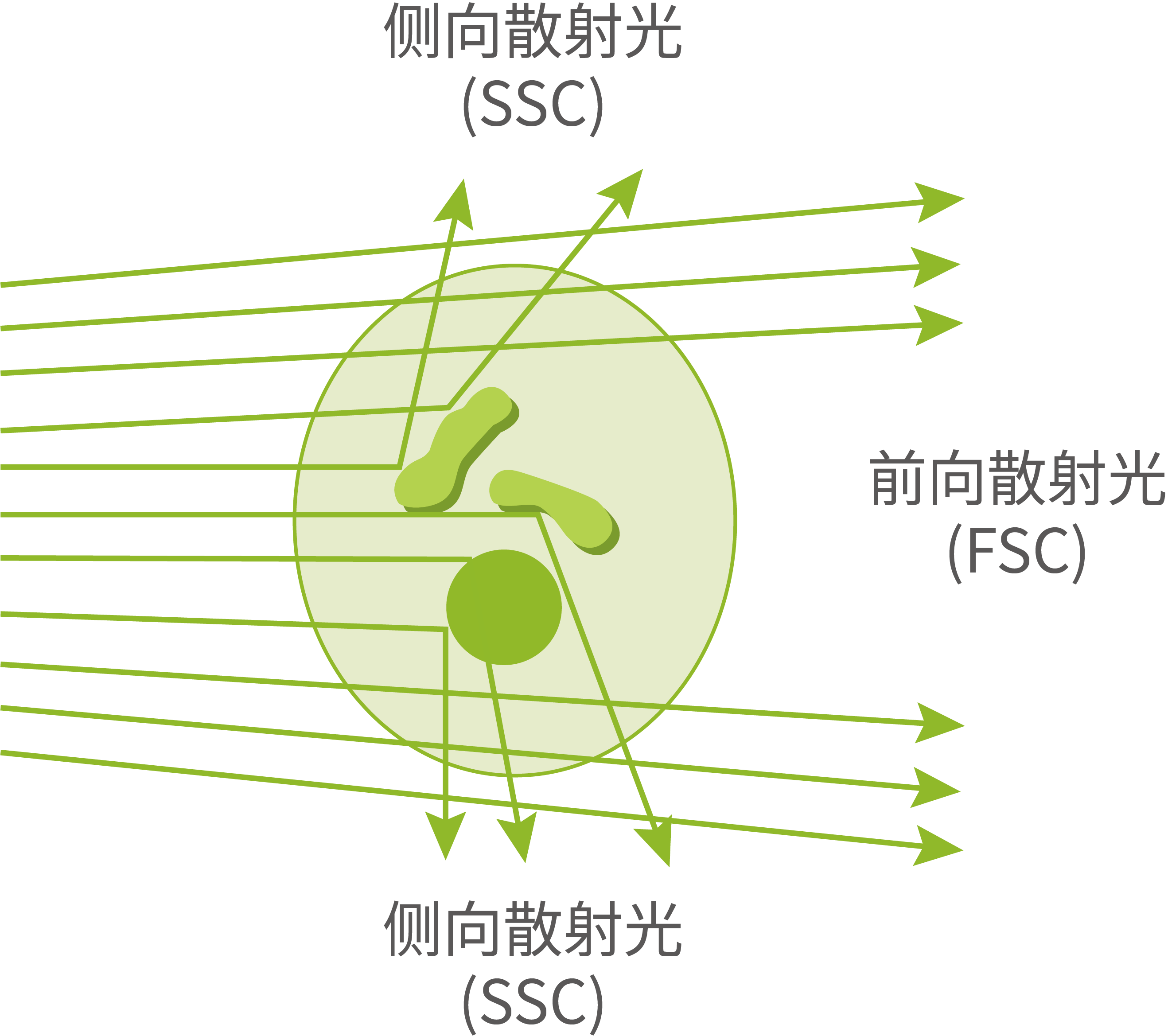
光学系统由激发光源、分光镜、滤光片以及产生光电流的检测系统组成。样品通过激光时,仪器会记录各单个细胞的前向散射光(FSC)和侧向散射光(SSC)。FSC主要用于检测细胞的相对大小,细胞越大,产生的FSC就越强。SSC则用于评估细胞的内部复杂性,细胞内的颗粒成分和精细结构越复杂,产生的SSC就更强。经荧光染色的细胞受到合适的光激发后会产生许多不同波长的荧光信号,分光镜和滤光片可以将入射的激光束按照特定的角度和波长进行分散和反射,使不同波长的光聚焦于不同的位置上。之后光信号通过光电倍增管(Photomultiplier tube, PMT)转化为电信号,传输到数据处理系统。
对照设置
首先,我们需要了解非特异性信号产生的原因:比如常见的肿瘤细胞自发荧光,会造成背景信号干扰;又如在单核细胞、巨噬细胞、树突状细胞和B细胞上,Fc受体均呈现高表达,在染色过程中抗体Fc端与细胞表面Fc受体的结合以及抗体与细胞的物理结合与粘附等,也会造成非特异性染色的发生;样本中的死细胞不仅具有更强的自发荧光,而且更容易产生非特异性结合,造成假阳性;除此以外,质粒转染、病毒感染、药物处理、体外共培养等也可能会引入荧光信号,对流式检测结果造成一定干扰。
为了避免上述情况,在流式染色前需要使用Fc受体阻断剂对Fc受体造成的非特异性染色加以去除。除此之外,还需要根据实验具体情况设置以下几种对照来排除非特异性信号。

单染对照
由于荧光染料发射光不是一个单一的波长,而是覆盖一定范围,所以会有荧光渗漏到邻近波长的检测器,在进行多色流式实验时,检测的颜色越多,越容易发生荧光渗漏。校正溢漏的过程被称为补偿,补偿可确保检测器只计算该通道特定的荧光发射光。单染对照是只添加一种荧光抗体的样本,可以显示出不同荧光基团之间光谱重叠的水平,并据此去除或补偿它们之间的重叠。荧光补偿调节设定好后,阳性细胞群应位于“目标通道阳性、其他通道阴性"的右下象限,阴性细胞群位于左下象限,两群体应垂直或平行于横纵坐标轴,左上象限不应有明显信号。同时,单染对照还可以辅助调节通道电压,把阳性峰调节到合适的位置,防止信号超出接收范围。
1.单染对照细胞样本,因为电压和背景更接近实际样本,无合适细胞样本时,可用微球代替。
2.同一通道内的荧光染料具有不同的发射光谱,因此单染样本的荧光染料必须与实验样本中的保持一致,例如GFP和FITC这两种荧光染料是不能相互替换的,因为两者的发射光谱不一致。
3.实验中有几种不同的荧光染料,就需要设置几个单染对照组,一个也不能少。
4.由于复合染料的差异,单染对照的复合染料标记抗体应当与实验所用的抗体相同(来自同一支抗体)。使用相同的复合荧光染料偶联不同的抗体,甚至仅是不同批次抗体,都可能会导致计算结果不准确。
5.单染对照的染色结果必须与实验样本亮度相同或更高,以模拟实验中的任何荧光溢漏情况。
6.对于任何对照,阴性和阳性群体的自发荧光必须相同。做法是单独为每个通道的阳性和阴性群设门,避免使用通用的阴性对照。
7.单染对照的染色结果,必须要阴阳分群明显。全阴性,全阳性或者阴阳分群不明显的样本都不可作为单染对照。
8.补偿依赖于荧光强度中位值的准确计算,软件能对荧光的溢出进行统计学显著性确定,如果事件太少,将无法准确计算,因此事件收集数量应多于5000个。
9.单染对照和实验样本的处理要相同,上机电压也要保持一致。
10.一些低表达靶标(例如IL-17A、IFN-γ等)的阳性细胞群非常少,调节补偿时,软件不能正确识别甚至识别不出,此时可以选择该样本高表达的一些靶标(例如CD3、CD4等),用相同的荧光标记来代替低表达靶标。
11.补偿值一般不会超过100%,如果出现超过100%的情况,可能是串联染料断裂导致。另外,补偿值不会出现负值,如果出现,则表示某些通道存在过补偿。
12.软件自动调节完补偿,可以打开补偿面板,观察一下每个通道的补偿是否合理。若不合理,可以适当进行微调。
13.为了更合理地圈出阴阳群,我们可以先根据FSC和SSC,圈出对应细胞群,这样更有利于调节补偿。
抗体捕获微球与抗体重链结合,因此与生物样本不同,不需要特异性抗原识别。作为实用性补偿试剂,这些微球可提高补偿的一致性,特别适用于:
1.阳性群体染色暗淡或稀少。补偿微球具有强烈的荧光信号,使得补偿对照的亮度与实验样本相同或更高。
2.需要处理多种荧光染料。
3.样本数量有限。