欢迎来到北京博奥森生物技术有限公司网站!
欢迎来到北京博奥森生物技术有限公司网站! 欢迎来到北京博奥森生物技术有限公司网站!
欢迎来到北京博奥森生物技术有限公司网站!
在基因功能研究和疾病机制探索中,基因敲除(KO)技术已成重要的科研工具。为满足科研工作者对高质量KO模型的需求,我们推出了一系列经严格验证的KO细胞系及配套裂解液产品,覆盖多种热门靶点,助力您的研究更高效、更精准!
产品优势
定制化服务:支持热门靶点快速交付,也可根据需求定制特定基因KO细胞模型,涵盖Hela、HEK293T、A549、HCT116、Hep G2和MCF7等KO细胞系,灵活满足科研需求。
产品展示
Bioss 的KO系列产品仍在持续研发更新验证中,本期为大家带来8月上新及推荐的KO细胞系和对应的裂解液产品,请欣赏我们的验证数据~
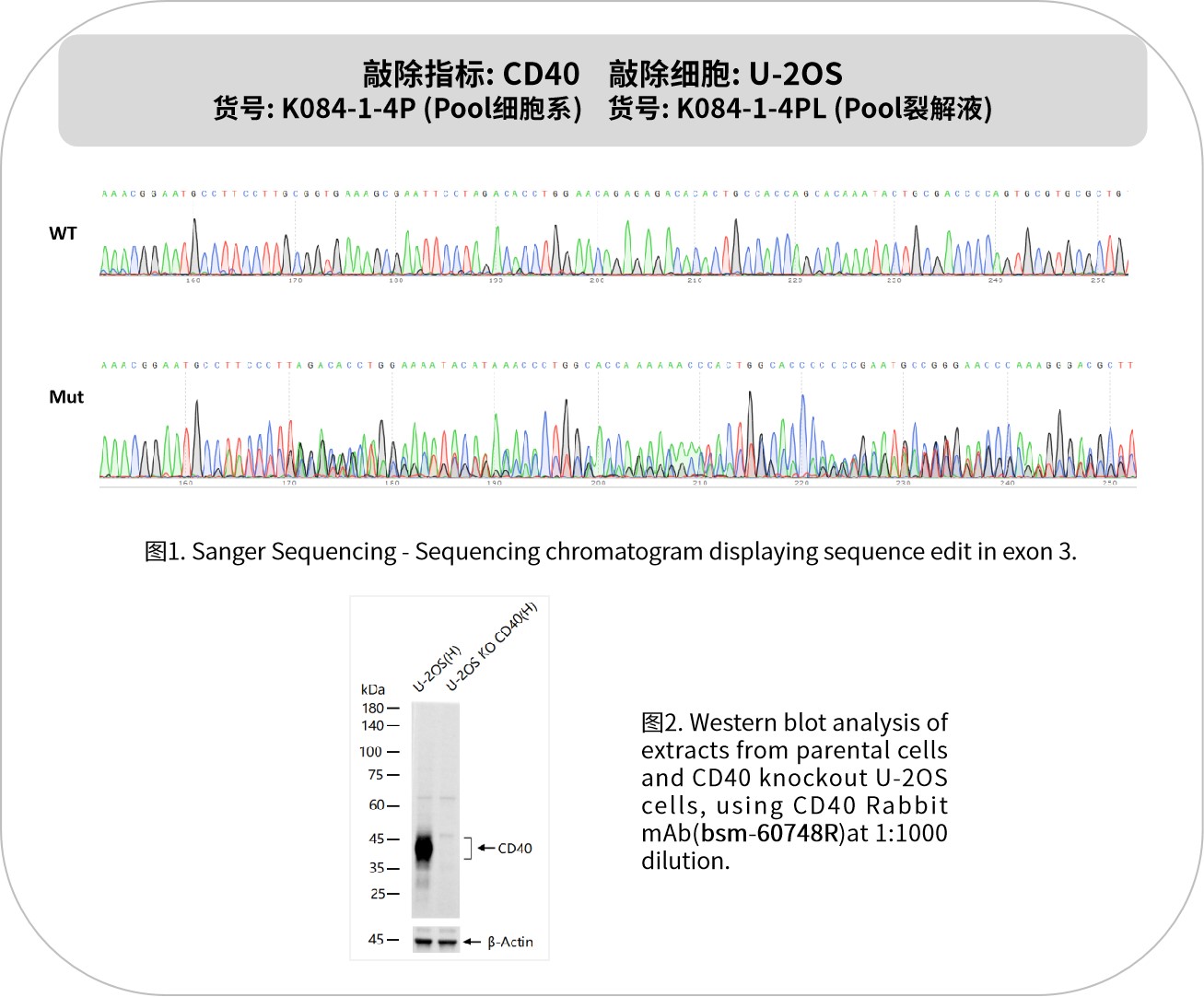
CD40是一种关键的免疫共刺激分子,属于肿瘤坏死因子受体超家族(TNFRSF)成员。主要分布于B细胞、树突状细胞(DC)、单核细胞、巨噬细胞等免疫细胞。CD40与CD40L结合后,激活B细胞增殖、抗体类别转换(如IgM→IgG/IgA/IgE),促进记忆B细胞生成;增强树突状细胞成熟,上调MHC II类分子和共刺激分子表达,增强抗原呈递能力;诱导巨噬细胞分泌炎症因子(如TNF-α、IL-12),增强吞噬能力。CD40还参与T细胞与B细胞的相互作用,促进T细胞极化(如TH1/TH2平衡),调节免疫应答的强度和方向。CD40激动剂通过激活免疫应答增强抗肿瘤效果,多项激动剂药物已进入临床研究;而在自身免疫疾病领域,抑制CD40信号则显示出潜在的治疗价值。
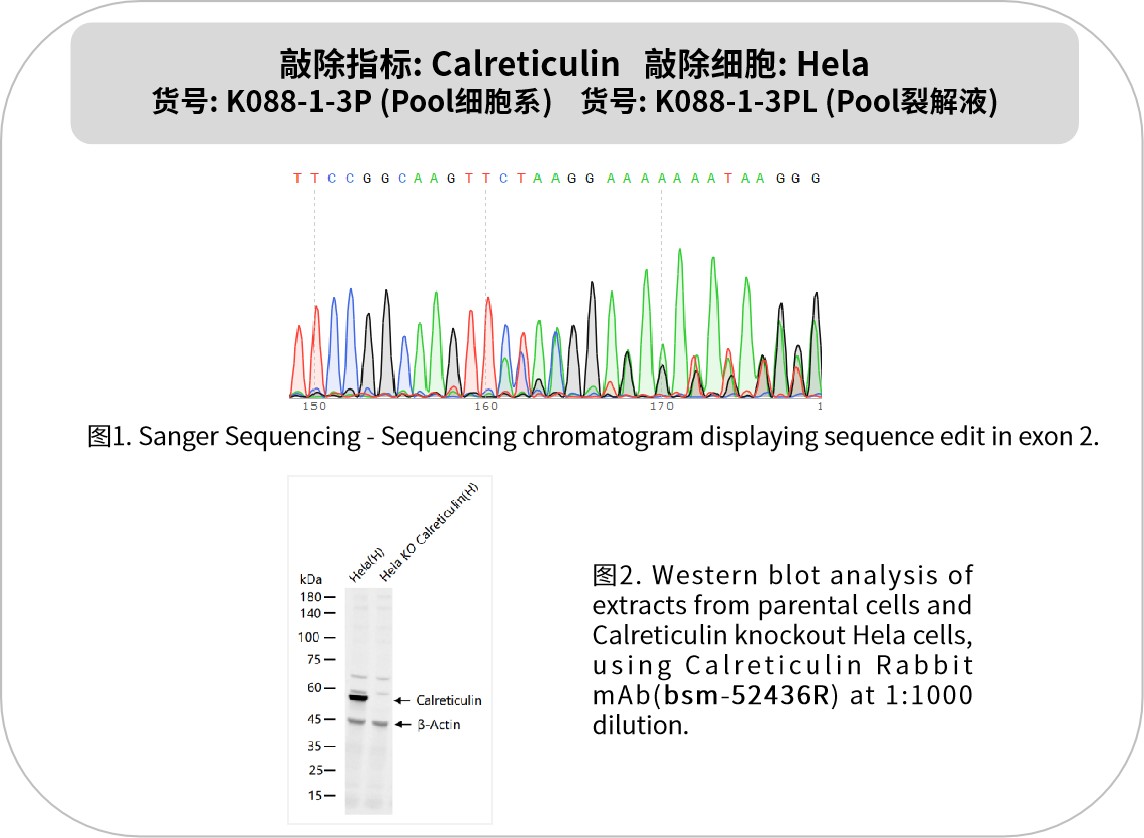
钙网蛋白(Calreticulin, CRT)是内质网核心伴侣蛋白,通过调控蛋白质折叠、钙稳态及免疫信号传递,在肿瘤、免疫应答和细胞应激中发挥关键作用。作为肿瘤免疫监视的核心标志物,CRT膜转位可激活自然杀伤(NK)细胞并促进树突状细胞(DC)抗原呈递,显著增强免疫检查点抑制剂疗效。例如,奥沙利铂等化疗药物通过诱导CRT暴露,提升肿瘤细胞免疫原性,临床数据显示CRT表达水平与弥漫大B细胞淋巴瘤预后密切相关。在肿瘤微环境中,CRT通过调节TGF-β信号通路和调节性T细胞(Treg)扩增,影响免疫逃逸机制。靶向CRT/TGF-β轴可恢复T细胞活性,为骨髓增生性肿瘤等治疗提供新策略。此外,CRT在食管鳞癌等实体瘤中高表达,与浸润深度及转移呈正相关,是潜在的诊断标志物。
帕金森病(Parkinson's Disease, PD)是全球两大神经退行性疾病,也是最常见的与年龄相关的神经运动障碍。帕金森病的主要特征是中脑黑质致密部的多巴胺神经元丧失,伴随α-突触核蛋白(α-synuclein, 简称α-syn)异常聚集,形成路易小体和路易神经突。
α-synuclein是一种天然无序蛋白,广泛存在于神经元中,特别是在突触囊泡内。它在突触囊泡中具有较高的浓度,也可在细胞质中以未折叠的单体形式存在。在正常条件下,α-synuclein以可溶、动态的形式存在,参与突触囊泡的维持及神经信号的传递。在帕金森病的发病过程中,α-synuclein发生错误折叠,形成不溶性的聚集体,这些聚集体包括寡聚体、原纤维和淀粉样纤维。错误折叠后的α-synuclein聚集体具有毒性,能够破坏神经元功能,导致神经炎症,并最终导致神经元死亡。α-synuclein的聚集是帕金森病的关键病理特征之一。

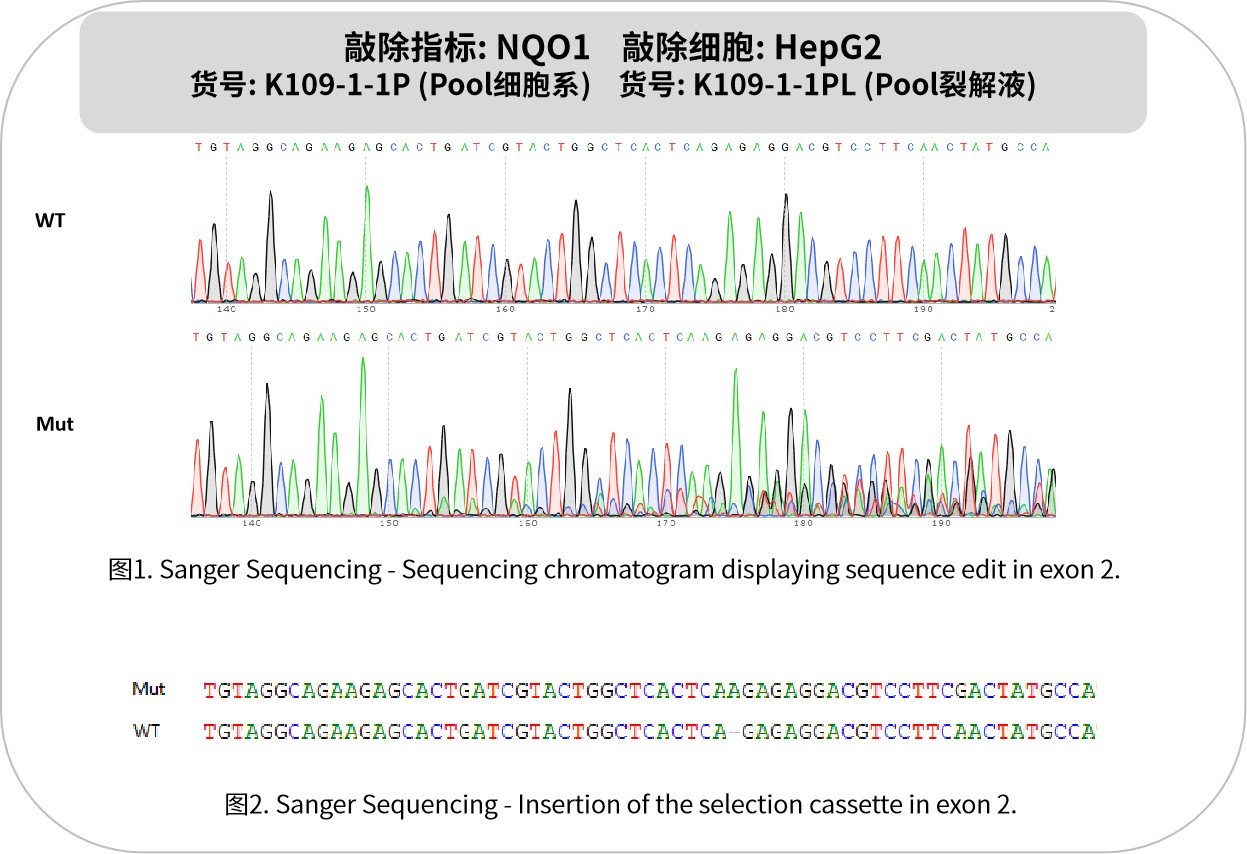
NQO1是一种双电子氧化还原酶,主要催化醌类化合物的还原反应,参与细胞内有害物质的解毒过程。它以NADH或NADPH为辅酶,将醌类化合物还原为无害的二羟基化合物,从而保护细胞免受氧化损伤。NQO1在多种肿瘤组织中表达显著上调,如肺癌、肝癌、结直肠癌、胶质母细胞瘤等。这种高表达与肿瘤细胞的增殖、侵袭和耐药性密切相关,使其成为肿瘤治疗的潜在靶点。其抗肿瘤机制主要包括:特异性激活前药(如吲哚醌类化合物),在肿瘤细胞内释放活性成分诱导凋亡;调控铁死亡和代谢过程,通过破坏氧化还原平衡选择性杀伤肿瘤细胞;调节免疫应答,增强免疫治疗效果。
MSI2(Musashi2)是一种重要的RNA结合蛋白,作为致癌因子在多种血液肿瘤和实体瘤(如AML、结直肠癌、肺癌等)中显著高表达,且与患者预后不良密切相关。它通过其RNA识别基序(RRM)与靶标mRNA(如Numbl、p21等)的3'非翻译区结合,进而抑制翻译或调节mRNA稳定性,从而精细调控基因表达。这一机制激活了多条关键致癌通路,包括mTORC1信号、Wnt/β-catenin和Notch通路,有效促进肿瘤细胞增殖、侵袭并维持肿瘤干细胞特性。此外,MSI2还通过增强DNA损伤修复能力(如激活ATM/CHEK2通路)及抑制凋亡,显著介导了对化疗、放疗及靶向治疗的耐药性。

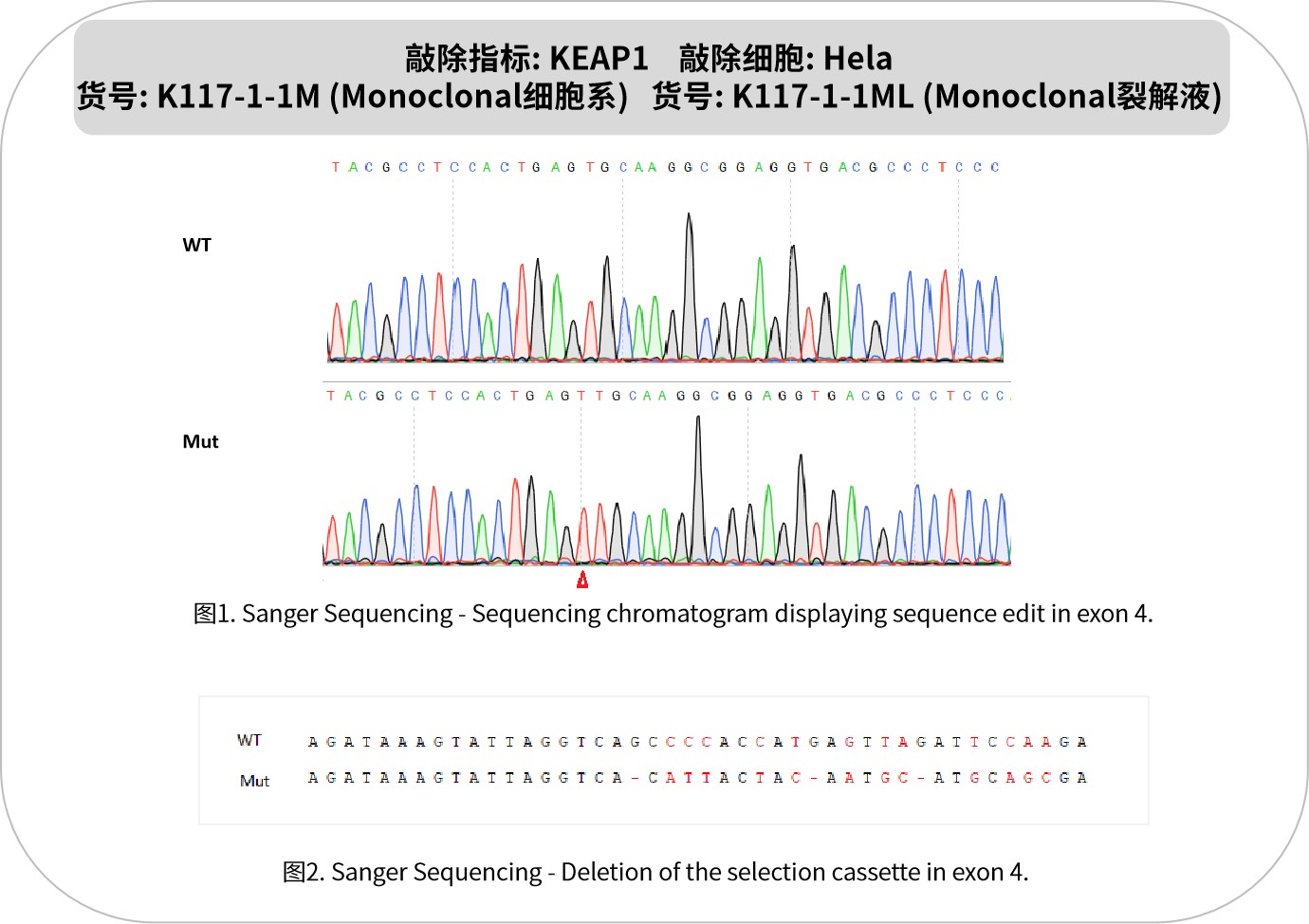
KEAP1是细胞抗氧化应激响应的关键调控蛋白,作为Cullin3泛素连接酶复合物的底物识别组分,主要负责调控转录因子NRF2的稳定性。在正常情况下,KEAP1介导NRF2的泛素化降解;当细胞遭遇氧化应激时,KEAP1构象改变导致NRF2释放入核,激活抗氧化基因表达,增强细胞抗氧化防御能力。在病理状态下,KEAP1功能丧失性突变或表达异常可导致NRF2通路持续激活,促进肿瘤进展、化疗耐药和免疫逃逸,尤其在非小细胞肺癌等恶性肿瘤中常见。该通路还参与慢性肾病和神经退行性疾病的发生。开发KEAP1抑制剂或NRF2激活剂是治疗相关疾病的重要方向。